| Viele organische Verbindungen
wurden analysiert - 1880 waren bereits über
15.000 organische Verbindungen bekannt -
und wurden anhand ihres Reaktionsverhaltens
in Gruppen wie Alkane, Alkohole, usw. eingeteilt.
Zwar traten auch hier schon das Probleme
auf, dass man eine Erklärung für das Verhalten
bestimmter Atome vergeblich versuchte, aber
erst die oben erwähnten physikalischen Experimente
zwangen zur Entwicklung eines differenzierteren
Atommodells.
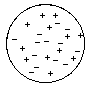 Man
versuchte zunächst eine Erklärung, die von
einer gleichmässigen Verteilung der negativen
Ladungen im ansonsten homogen positiven
Atom ausging. Man
versuchte zunächst eine Erklärung, die von
einer gleichmässigen Verteilung der negativen
Ladungen im ansonsten homogen positiven
Atom ausging.
(Thomson - Die Ladungsträger
sind im Atom verteilt wie Rosinen im Kuchen.
„Rosinenkuchenmodell“).
Das Entstehen von Ionen konnte so erklärt
werden, dass sich einzelne Elektronen aus
dem Atom entfernten und ein nun positiv
geladenes Teilchen, das Ion zurückblieb.
Ein wichtiger Schritt hin zum heutigen
Verständnis gelang Rutherford im Jahr 1911. |
