| Isotope |
| Ein indirekter Nachweis
der Existenz von Neutronen gelang mit Hilfe
der Massenspektroskopie.
Man fand heraus, dass natürliches Chlor
zwei Arten von Atomen (lsotope) enthält,
und zwar solche mit der Masse 35 u ( Cl-35
oder 35 Cl ) und
solche mit der Masse 37 u. Man konnte dieses
Phänomen mit Hilfe der Neutronen leicht
erklären:
Das Cl-35 enthielt 17 Protonen (Masse 17
u). 18 Neutronen (Masse 18 u) und 17 Elektronen
(Masse vernachlässigbar klein) —>
Masse 35 u.
Das Cl-37 enthielt 17 Protonen, 20 Neutronen
und 17 Elektronen —> Masse 37 u.
Das (prinzipielle)
chemische Verhalten von Cl-35 und Cl-37
ist absolut identisch. |
|
|

|
Isotope sind Nuklide mit gleicher
Protonenzahl, aber verschiedener Neutronenzahl.
Atomarten, die durch ihre Protonen- und
Neutronenzahl eindeutig gekennzeichnet
sind, bezeichnet man als Nuklide.
Die Zuordnung eines Atoms zu einem Element
erfolgt also aufgrund der Zahl seiner Protonen;
diese bleibt bei chemischen Reaktionen auch
unverändert. (Die Zahl der Elektronen ist
bei einem neutralen Atom natürlich gleich
der Zahl der Protonen; sie kann sich bei
chemischen Reaktionen aber ändern —>
lonenbildung)
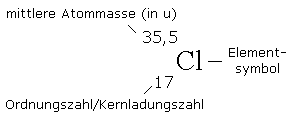
Wir können nun auch die Zahlen erklären,
die im Periodensystem die Elementsymbole
ergänzen.
Als Beispiel dient das Chlor:
|
|
|
Man unterscheidet also ein Chloratom,
das Chlornuklid Cl-35 und die Chlorisotope
Cl-35 und Cl-37.
Der erste Begriff bezieht sich auf das chemische
Verhalten; die beiden anderen Begriffe beziehen
sich auf den Aufbau des Atomkerns, der dem
Chemiker eigentlich ziemlich egal ist, da
er das chemische Verhalten (meist) nicht beeinflusst. |
|
|
| Erläuterungen:
Natürliches Chlor, etwa im Kochsalz (=
Natriumchlorid) besteht zu etwa 3/4 aus
Cl-35 und zu 1/4 aus Cl-37; unter Berücksichtigung
dieser Anteile ergibt sich als mittlere
Atommasse etwa 35,5 u.
Die Kernladungszahl gibt die Zahl der Protonen
und damit der positiven Ladungen im Atomkern
an. In einem neutralen Atom ist die Zahl
der Protonen gleich der Zahl der Elektronen,
da jede positive Ladung eines Protons durch
die negative Ladung eines Elektrons ausgeglichen
werden muss. Der Begriff Ordnungszahl bezieht
sich darauf, dass die Elemente nach der
Zahl ihrer Protonen im Periodensystem angeordnet
sind.
Die Zahl der Neutronen kann man übrigens
nur bei Nukliden aus der Ordnungszahl und
der Nuklidmasse ermitteln:
Zahl der Neutronen = Nuklidmasse - Protonenzahl
(=Ordnungszahl)
Aus der mittleren Atommasse kann man auch
nur die mittlere Zahl von Neutronen ermitteln! |
|
|
Die „krummen“ Zahlen sind nicht
immer darauf zurückzuführen, dass die entsprechenden
Elemente Mischelernente sind, d.h. aus mehreren
Isotopen bestehen.
Auch Elemente wie lod, die ausschliesslich
aus einem Isotop bestehen, haben keine ganzzahlige
mittlere Atommasse. Dies liegt unter anderem
daran, dass die Masse eines Protons und eines
Neutrons nicht genau 1 u ist. (-> E=m·c²)
|
|
|
| Bei der Untersuchung
der Elemente des Periodensystems mit Hilfe
des Massenspektrometers stellte sich heraus,
dass die Zahl der natürlich vorkommenden
Isotope eines Elements höchst unterschiedlich
ist.
Elemente wie Natrium, Phosphor oder Cobalt
besitzen nur ein Isotop (Reinelemente);
Zinn besteht aus 10 (zehn) verschiedenen
Isotopen. |
|
|
|
